Bei Diabetikern sind chronisch infizierte Wunden oft ein großes Problem. Einen raffinierten Heilungsansatz aus der Nanomedizin präsentiert ein chinesisches Forschungsteam in der Zeitschrift Angewandte Chemie. Die Wissenschaftler:innen schalteten die wundverursachenden Bakterien mit einer Lösung aus Nanokapseln aus, die das Wundmilieu verändern und reaktive Sauerstoffspezies ausschütten.
Bakterien finden in chronischen Wunden von Diabetikern einen idealen Nährboden. In der glukosereichen Umgebung bilden sie Biofilme, die Antibiotika nur schwer durchdringen können. Zudem ist das körpereigene Immunsystem häufig geschwächt. Einen erfolgversprechenden Ansatz bildet hier die chemodynamische Therapie. An Ort und Stelle produzierte reaktive Sauerstoffspezies schwächen und schädigen die Bakterienzellen, bis sie absterben.
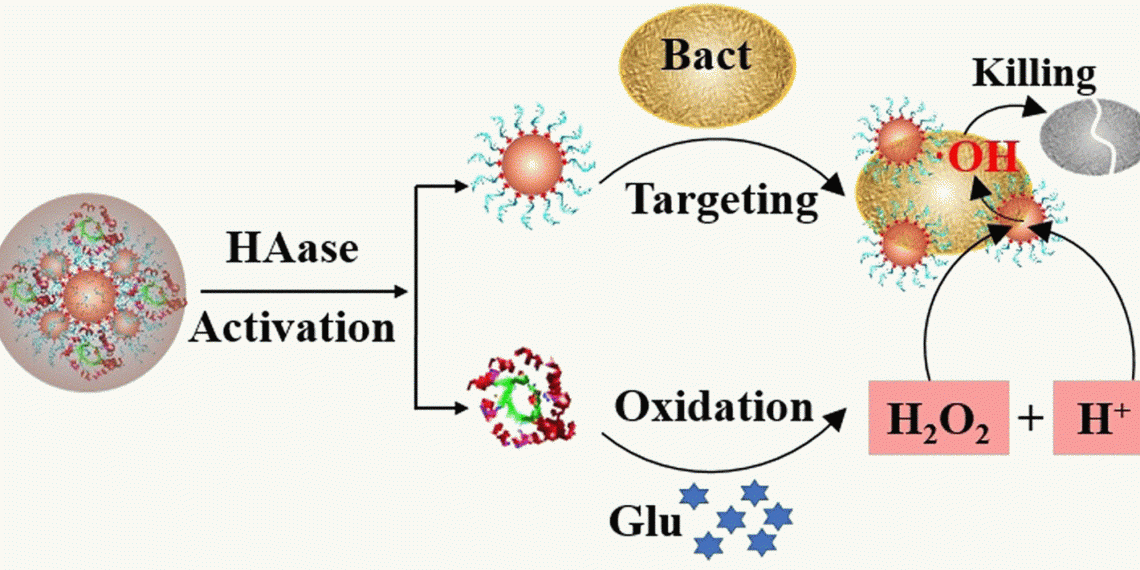
Die Produktion der Sauerstoffradikale übernimmt ein Katalysator. Er zersetzt Wasserstoffperoxid in unmittelbarer Umgebung der Zelle, am besten direkt auf oder in der Zellwand. Als Katalysator eignen sich Platin-Nanopartikel besonders gut. Diese Nanopartikel sind mit Aptameren besetzt – kurze DNA-Stücke, die an Bakterien binden. Wegen ihrer Aktivität, die an die von Enzymen erinnert, werden solche Katalysatorkpartikel Nanozyme genannt. Das Nanozym heftet sich an die Bakterien und setzt – sofern Wasserstoffperoxid vorhanden ist – Sauerstoffradikale in der Zelle frei.
Der Katalysator kann das Wasserstoffperoxid jedoch nur im Sauren zersetzen, also bei niedrigem pH. In einer typischen Diabeteswunde herrscht jedoch ein alkalisches Milieu vor. Um das Nanozymsystem dennoch arbeiten zu lassen, griffen Ronghua Yang von der Changsha University of Science and Technology in Changsha (China) und seine Kolleg:innen in die biochemische Trickkiste.
Das Team machte sich den Umstand zunutze, dass Diabeteswunden reich an Glukose sind. Das mikrobielle Enzym Glucoseoxidase, das aus der medizinischen Diagnostik und der Lebensmittelindustrie bekannt ist, setzt Glukose mit Sauerstoff zu Gluconsäure um, wobei Wasserstoffperoxid sowie eine saure Lösung entstehen. Also hefteten die Forscher:innen dieses Enzym auf die Nanozyme. Schließlich betteten sie alles in eine schützende Hülle aus Hyaluronsäure.
Durch die Hülle wuchsen nicht nur die Nanozym-Partikel um das Fünffache auf etwa 0,1 Mikrometer an (was ein Zehntel der Bakteriengröße ist), sie wurden auch stabil und hielten mindestens 30 Tage in Lösung ohne Veränderung durch. Außer zur Stabilisierung diente die Hyaluronsäurehülle noch einem weiteren Zweck: Bakterien geben Enzyme ab, die Hyaluronsäure zersetzen. Das bedeutet, dass die Bakterien das gegen sie gerichtete System selbst aktivieren, so der Gedankengang der Forschenden.
Auf Bakterienkulturen von Staphylococcus aureus angesetzt, vernichtete die Nanokapsel-Lösung die Bakterien innerhalb weniger Stunden. Dann behandelten die Forscher:innen damit chronisch infizierte Wunden von Diabetes-kranken Mäusen. Das Ergebnis war eindeutig: Unter identischen Bedingungen heilten nur mit der Nanokapsel-Lösung versorgten Wunden vollständig und schnell.
„Dafür mussten wir keine neuen Nanomaterialien herstellen“, schreiben die Autor:innen. „Wir lösten die physiologischen Einschränkungen der Nanozyme durch Regulation der lokalen Mikroumgebung.“ Auch für andere Nanozym-Systeme würden sich solche Anpassungen eignen, argumentieren sie weiter.
Kontrollwaage mit OPC UA-Schnittstelle
Das ChemieunternehmenbBASF setzt am Standort Ludwigshafen auf moderne Technologien zur Optimierung der Intralogistik. In diesem Kontext spielt die Zusammenarbeit mit...
Read more